Olá!!!
Aqui está um site interativo muito útil! Dá para fazer moléculas, ver a sua polaridade... e muito mais!!!
Descubram muito mais no: http://www.molecularium.com/kidsite.html
Túlio
Olá, hoje vou falar sobre um elemento químico: o Túlio.
O túlio é um elemento químico com número atómico 68, representa-se com o símbolo "Tm", tem uma massa atómica de 168,9 u e na Tabela Periódica pertence ao grupo dos lantanídeos. É um elemento químico sólido, metálico, mole e maleável.
O túlio tem 32 isótopos mas apenas um deles é estável.
A sua cor é cinza-prateado e tem um brilho metálico. Apenas apresenta resistência à corrosão se o ar não tiver uma grande quantidade de humidade.

O seu manuseamento tem que ser feito com muito cuidado pois além de ser tóxico, o seu pó metálico pode entrar em combustão e tornar-se explosivo.
O túlio pode ser utilizado na produção de laser, na fonte de radiação em dispositivos portáteis de raios-x e materiais magnéticos em microondas. Devido ao seu elevado custo, o seu uso comercial é baixo.
Onde pode ser encontrado:
O túlio é um metal muito raro e pode ser encontrado em areias ou extraído em pequenas quantidades de outros metais semelhantes.
História:
 Em 1879, o químico sueco Per Teodore Cleve estava a procurar impurezas em diferentes elementos metálicos e descobriu duas novas substâncias: uma era o óxido de hólmio e a outra era o óxido de túlio.
Em 1879, o químico sueco Per Teodore Cleve estava a procurar impurezas em diferentes elementos metálicos e descobriu duas novas substâncias: uma era o óxido de hólmio e a outra era o óxido de túlio.O nome "Túlio" teve origem na palavra "Thule" que foi um nome romano antigo de um país situado na Escandinávia.
Polaridade das Moléculas
Quando as moléculas são constituídas por dois átomos diferentes dizem-se MOLÉCULAS POLARES.
Quando as moléculas são constituídas por dois átomos iguais dizem-se MOLÉCULAS APOLARES.
Ligações químicas
Ligações químicas são uniões estabelecidas entre átomos para formarem moléculas. A união estabelecida entre átomos não ocorre de qualquer forma, por isso tem de haver condições apropriadas para que a ligação entre eles ocorra. Existem vários tipos de ligações, e eu vou vos explicar todas:
Ligação covalente:
É uma ligação química onde há partilha de electrões entre os átomos constituintes da molécula.Pode ser simples, dupla ou tripla de acordo com o nº de pares de electrões compartilhados.
- Ligação covalente simples: ligação química onde participa um par de electrões. Simboliza-se por um traço entre os átomos ligados.

- Ligação covalente dupla: ligação química onde participam dois pares de electrões. Simboliza-se por dois traços entre os átomos ligados.

- Ligação covalente tripla: ligação química onde participam três pares de electrões. Simboliza-se por três traços entre os átomos ligados.

Curiosidades da tabela periódica
Esta tabela periódica interativa foi criada para a exposição ´Science Storms´ no Museu de Ciência e Tecnologia de Chicago (EUA).
Ficam aqui mais algumas curiosidades neste video:
O sistema permite que os visitantes interajam com os elementos da tabela
periódica por meio de peças móveis sobre uma mesa. Ao colocar uma peça
sobre um elemento, o sistema fornece as informações sobre a sua
importância no mundo e exibe uma fotografia.
Ainda não decoraram os elementos da tabela periódica?!? Aqui está uma música para vos ajudar a decorar! :)
Ficam aqui mais algumas curiosidades neste video:
Tabela Periódica
Já todos nós ouvimos falar da tabela periódica, vamos saber um pouco mais sobre ela!!!!
A
Tabela Periódica é uma forma de organizar os elementos químicos segundo
as semelhanças das propriedades físicas e químicas. É constituída por
sete linhas, os períodos, que correspondem ao número de níveis de energia, e dezoito colunas, os grupos, que correspondem aos elementos que têm os mesmos eletrões de valência.
Os
elementos do grupo 1 têm 1 eletrão de valência, os do grupo 2 t~em 2
eletrões de valência, passando para o grupo 13, que têm 3 eletrões de
valência e sucessivamente até ao grupo 18. Do grupo 3 ao 11 temos os metais
que têm um comportamento especial, não contando os eletrões de valência.Estrutura da tabela periódica:
A tabela está divida, de um modo geral, em dois grandes grupos, os metais e os não-metais.Grupo 1- Metais de alcalinos:
São elementos com carateristicas básicas ou alcalinas, pois reagem com a água. Têm um brilho metálico, são bons condutores elétricos e térmicos e têm elevados pontos de fusão e ebulição. Têm um eletrão de valência, originando catiões, sendo estes iões monopositivos.Grupo 2- Metais alcalino-terrosos:
Grupo 17- Halogéneos:
São
elementos que não possuem propriedades metálicas, muito reativos, pouco
solúveis na água e solúveis em solventes orgânicos, têm pontos de fusão
e ebulição relativamente baixos. Têm sete eletrões de valência,
originando iões mononegativos
Grupo 18- Gases Nobres:
São
elementos que possuem a última camada completamente preenchida, sendo
por isso muito estáveis. Têm pontos de fusão e ebulição muito baixos.
A evolução do modelo atómico
Nem sempre o homem pensou que o átomo é como o conheces atualmente. Foi uma ideia que evoluiu ao longo dos anos!
Modelo atómico de Dalton:
John Dalton, no séc. XIX, retomou a ideia dos átomos como constituintes básicos da matéria. Para ele os átomos seriam partículas pequenas, indivisíveis e indestrutíveis. Cada elemento químico seria constituído por um tipo de átomos iguais entre si. Quando combinados, os átomos dos vários elementos formariam compostos novos.
Concluiu, também, que:
-
Os átomos que pertencem a elementos químicos diferentes, apresentam massas diferentes, assim como propriedades químicas diferentes.
-
Os compostos são associações de átomos de elementos químicos diferentes.
 | |
| Modelo atómico de Dalton |
Modelo atómico de Thomson:
Em 1897, Thomson descobriu partículas negativas muito mais pequenas que os átomos, os eletrões, provando assim que os átomos não eram indivisíveis.
Formulou a teoria de que os átomos seriam uma esfera com carga elétrica
positiva, onde estariam dispersos os eletrões suficientes para que a
carga total do átomo fosse nula.
 |
| Modelo atómico de Thomson |
Modelo atómico de Rutherford:
Mais tarde, Rutherford demonstrou que a maior parte
do átomo era espaço vazio, estando a carga positiva localizada no núcleo, tendo este a maior parte da massa do átomo.
Os eletrões estariam a girar em torno do núcleo.
Rutherford também descobriu a existência dos protões, as partículas com carga positiva que se encontram no núcleo.
 |
| Modelo atómico de Rutherford |
Modelo atómico de Bohr:
Bohr fez alterações ao modelo de Rutherford: os eletrões só
podem ocupar níveis de energia bem definidos, e os eletrões giram em
torno do núcleo em órbitas com energias diferentes. Quando um
eletrão recebe energia suficiente passa a ocupar uma órbita mais externa
(com maior energia). Se um eletrão
passar de uma órbita para uma outra mais interior liberta energia.
 |
| Modelo atómico de Bohr |
Modelo da núvem eletrónica:
No núcleo do átomo estão os protões e os neutrões, enquanto que os eletrões giram em seu redor. Na figura ao lado está representada a nuvem eletrónica de um átomo. Esta nuvem representa a probabilidade de encontrar os eletrões num determinado local do espaço.
Os eletrões de um átomo ocupam determinados níveis de
energia (o número de eletrões em cada nível de energia é expresso pela
distribuição eletrónica).
 |
| Modelo da nuvem eletronica |
Átomo
Vamos começar por falar do átomo, do nºatómico e do nº de massa!!!
Em relação ao átomo podemos dizer que este é constituido pelo núcleo e pela nuvem eletrónica.
O núcleo é constituido pelos neutrões(que não têm carga) e pelos protões(que têm carga positiva).
A nuvem eletrónica é constituida apenas pelos eletrões(que têm carga negativa).
Num átomo o nº de eletroes é sempre igual ao nº de protões.
Deste modo, podemos concluir que um átomo nao tem, nem carga positiva, nem carga negativa. Tem uma carga neutra.
Falando agora do nº atómico(Z), podemos dizer que este é o nº de protões ou de eletrões de um átomo.
Este número representa-se à esquerda e em baixo do símbolo químico do elemento.
O nº de massa(A) é o número de nucleões, ou seja, é o número de protões e de neutrões que existem no núcleo de um átomo. Este número representa-se à esquerda e em cima do símbolo químico do elemento.
Defeitos de visão- video
Já vos mostrei a constituição do olho!! Agora vou-vos mostrar um video com os defeitos de visão!!! Espero que gostem! :)
O olho humano
O olho humano é o órgão responsável pela visão no ser humano.
Os constituintes do olho humano, responsáveis pela visão, são:
A cor dos olhos é determinada pelo tipo e quantidade de pigmentos na íris do olho. Os humanos e os animais têm muitas variações na cor dos olhos.
Os constituintes do olho humano, responsáveis pela visão, são:
- Córnea- parte transparente e protetora do olho.
- Pupila- orifício que regula a entrada de luz. Por ser um orifício, não tem cor, mas sua aparência é preta, pois não há iluminação na parte interna dos olhos.
- Cristalino- transparente, formado por duas superfícies convexas. Tem a função de concentrar os raios luminosos e direcioná-los à retina. É a estrutura responsável por ajustar o foco da visão.
- Retina- membrana mais interna do olho, onde se encontra o nervo óptico.
- Nervo ótico- responsável por enviar os estímulos luminosos ao cérebro.
 |
| Olho Humano |
 |
| Funcionamento do olho humano |
 | ||
| Reflexos da pupila humana, em resposta a estímulo luminoso. |
 |
| Cores dos olhos!! |
A lenda do arco-íris
O
João era pobre. O pai tinha morrido e era muito difícil a mãe manter a
casa e sustentar os filhos.
Um dia ela pediu-lhe que fosse pescar alguns peixes para o jantar.
O João reparou numa coisa a mexer-se no meio de um arvoredo. Aproximou-se sorrateiro, baixou-se, afastou as folhas devagarinho e . . . viu um pequeno homem sentado num pequeno banco de madeira. Costurava um colete verde enquanto cantarolava uma musiquinha.
À frente do João estava um anão. Rapidamente esticou o braço e prendeu o homenzinho entre os dedos.
- Boa tarde, meu senhor.
Como estás, João? - respondeu o homenzinho com um sorriso malicioso.
Mas o anão tinha montes de truques para se libertar dos humanos. Inventava pessoas e animais a aproximarem-se, para que desviassem o olhar e ele pudesse escapar.
- Diz-me lá, onde fica o tesouro do arco-íris?
Mas o anão gritou para o João que vinha lá um touro bravo a correr bem na sua direcção. Ele assustou-se, abriu a mão e o anão desapareceu.
O João sentiu uma grande tristeza, pois quase tinha ficado rico.
E, com estas reviravoltas, voltou para casa de mãos a abanar, sem ter pescado peixe nenhum. Mal chegou contou à mãe o sucedido. Esta, que já conhecia a manha dos anões, ensinou-o:
-Se alguma vez o encontrares, diz-lhe que traga o tesouro imediatamente.
Passaram-se meses.
Até que um dia, ao voltar para casa, sentiu os olhos ofuscados com um brilho intenso. O anão estava sentado no mesmo pequeno banco de madeira, só que desta vez consertava um dos seus sapatos.
- Cuidado! Vem lá o gavião! - gritou o anão, fazendo uma cara de medo.
- Não me tentes enganar! - disse o João. - Traz já o pote de ouro! Traz já o pote de ouro ou eu nunca mais te solto!!!
- Está bem! - concordou o anão. - Desta vez ganhaste!
O pequeno homem fez um gesto com a mão e imediatamente um belíssimo arco-íris iluminou o céu, saindo do meio de duas montanhas e terminando bem aos pés do João.
As 7 cores eram tão intensas que até esconderam o pequeno pote de barro, cheio de ouro e pedras preciosas, que estava à sua frente.
O anão baixou-se, com o chapéu fez-lhe um aceno de despedida, e gritou, pouco antes de desaparecer para sempre:
- Adeus, João! És um menino esperto! Terás sorte e serás feliz para sempre!
E foi o que aconteceu. O pote de ouro nunca se esgotou e o João e a sua família tiveram uma vida com muita furtuna e muita alegria.
Um dia ela pediu-lhe que fosse pescar alguns peixes para o jantar.
O João reparou numa coisa a mexer-se no meio de um arvoredo. Aproximou-se sorrateiro, baixou-se, afastou as folhas devagarinho e . . . viu um pequeno homem sentado num pequeno banco de madeira. Costurava um colete verde enquanto cantarolava uma musiquinha.
À frente do João estava um anão. Rapidamente esticou o braço e prendeu o homenzinho entre os dedos.
- Boa tarde, meu senhor.
Como estás, João? - respondeu o homenzinho com um sorriso malicioso.
Mas o anão tinha montes de truques para se libertar dos humanos. Inventava pessoas e animais a aproximarem-se, para que desviassem o olhar e ele pudesse escapar.
- Diz-me lá, onde fica o tesouro do arco-íris?
Mas o anão gritou para o João que vinha lá um touro bravo a correr bem na sua direcção. Ele assustou-se, abriu a mão e o anão desapareceu.
O João sentiu uma grande tristeza, pois quase tinha ficado rico.
E, com estas reviravoltas, voltou para casa de mãos a abanar, sem ter pescado peixe nenhum. Mal chegou contou à mãe o sucedido. Esta, que já conhecia a manha dos anões, ensinou-o:
-Se alguma vez o encontrares, diz-lhe que traga o tesouro imediatamente.
Passaram-se meses.
Até que um dia, ao voltar para casa, sentiu os olhos ofuscados com um brilho intenso. O anão estava sentado no mesmo pequeno banco de madeira, só que desta vez consertava um dos seus sapatos.
- Cuidado! Vem lá o gavião! - gritou o anão, fazendo uma cara de medo.
- Não me tentes enganar! - disse o João. - Traz já o pote de ouro! Traz já o pote de ouro ou eu nunca mais te solto!!!
- Está bem! - concordou o anão. - Desta vez ganhaste!
O pequeno homem fez um gesto com a mão e imediatamente um belíssimo arco-íris iluminou o céu, saindo do meio de duas montanhas e terminando bem aos pés do João.
As 7 cores eram tão intensas que até esconderam o pequeno pote de barro, cheio de ouro e pedras preciosas, que estava à sua frente.
O anão baixou-se, com o chapéu fez-lhe um aceno de despedida, e gritou, pouco antes de desaparecer para sempre:
- Adeus, João! És um menino esperto! Terás sorte e serás feliz para sempre!
E foi o que aconteceu. O pote de ouro nunca se esgotou e o João e a sua família tiveram uma vida com muita furtuna e muita alegria.
O arco-íris!!!
Como a luz solar é composta de cores diferentes, estas refletem ao curvarem-se nas gotas de água. Neste processo, as cores separam-se como ocorre num prisma de vidro. Desta forma, podemos ver no céu as cores do arco-íris (vermelho, laranja, amarelo, verde, azul, anil e violeta).
 |
| Formação do arco-íris |
 |
| Arco-íris!!! |
Aqui têm um video para perceberem melhor como se forma o arco-íris!!!!!!!
Quais os sons que nós conseguimos ouvir??
Hoje, vou vos falar outra vez do som! Mas desta vez vou desenvolver o tema espetro sonoro.
Nem todas as vibrações que atingem os nossos ouvidos são, por estes percepcionadas. O conjunto de todas as frequências possíveis para as ondas sonoras é denominado espetro sonoro.
De acordo com a frequência da onda sonora, classificam-se os sons em: infra-sons, sons audíveis( para o ser humano) e ultra-sons.

Nem todas as vibrações que atingem os nossos ouvidos são, por estes percepcionadas. O conjunto de todas as frequências possíveis para as ondas sonoras é denominado espetro sonoro.
De acordo com a frequência da onda sonora, classificam-se os sons em: infra-sons, sons audíveis( para o ser humano) e ultra-sons.

Os instrumentos
Olá!!!!
Todos os instrumentos produzem som! Vamos tentar perceber um bocadinho como é que o som se reproduz.
Existem instrumentos de precussão, de sopro e de cordas.
Os instrumentos de precussão são por exemplo: o triângulo. o reco-reco, os pratos...
Nestes instrumentos a vibração de todo o instrumento musical é que produz o som.
Os instrumentos de sopro são, por exemplo: o clarinete, o trompete, a flauta...
Nestes inistrumentos a circulação do ar é que provoca a oscilação de componentes do instrumento musical, produzindo sons.
Os instrumentos de cordas são, por exemplo: o violino, a guitarra portuguesa, a harpa...
Nestes instrumentos o som é provocado pela vibração de parte do instrumento: as cordas, quando friccionadas ou percutidas.
Alguns instrumentos têm um caixa de ressonância. Esta serve para aumentar a intensidade do som. Alguns instrumentos que contêm uma caixa de ressonância são: o piano, o violão e o tambor.
Todos os instrumentos produzem som! Vamos tentar perceber um bocadinho como é que o som se reproduz.
Existem instrumentos de precussão, de sopro e de cordas.
Os instrumentos de precussão são por exemplo: o triângulo. o reco-reco, os pratos...
Nestes instrumentos a vibração de todo o instrumento musical é que produz o som.
 |
| Triângulo |
Os instrumentos de sopro são, por exemplo: o clarinete, o trompete, a flauta...
Nestes inistrumentos a circulação do ar é que provoca a oscilação de componentes do instrumento musical, produzindo sons.
| Clarinete |
Os instrumentos de cordas são, por exemplo: o violino, a guitarra portuguesa, a harpa...
Nestes instrumentos o som é provocado pela vibração de parte do instrumento: as cordas, quando friccionadas ou percutidas.
| Violino |
Alguns instrumentos têm um caixa de ressonância. Esta serve para aumentar a intensidade do som. Alguns instrumentos que contêm uma caixa de ressonância são: o piano, o violão e o tambor.
| Caixa de ressonãncia com diapasão |
O som
Olá, hoje vou-vos falar um pouco sobre o som!!!!!
O som propaga-se através de ondas sonoras. Agora perguntam vocês: Mas o que é que são ondas??
Então, um onda é a propagação da perturbação num meio material ou não.
Podemos classificar as ondas sonoras quanto à sua natureza e quanto á sua direção da perturbação.
-Quanto á natureza podemos dizer que elas são mecânicas, porque precisam de um meio material para se propagarem.
-Quanto à direção da perturbação podemos dizer que elas são longituninais, porque a direção da propagação coincide com a direção da vibração.
 |
| Na imagem podemos observar as ondas longitudinais, podemos também verificar que a direção da propagação é a mesma que a direção da vibração. |

De certeza que já ouviram dizer que um som pode ser agudo ou grave. Quando as pessoas dizem isso estão a referir-se à altura do som. Costuma-mos associar o som agudo à voz da mulher e o som grave à voz do homem. Um som agudo tem uma alta frequência e um som grave tem uma baixa frequência.
Aqui vai uma ficha para ajudar a consolidar a matéria sobre as ondas e o som: Espero que ajude!!
Energia
Olá, hoje vou-vos falar das fontes e formas de energia!!
Existem duas fontes de energia:
- Fontes primárias
- Fontes secundárias.
As fontes secundárias é quando são obtidas a partir de outras fontes de energia. (gasolina, eletricidade)
As fontes primárias transformam os recursos primários em energia elétrica. Para isso, utilizam-se centrais. Cada central tem uma dsignação diferente, conforme a fonte de energia utilizada.
 |
Central solar (recurso: sol)
Em relação ás formas de energia, podemos encontrar duas formas:
- A energia cinética- energia associada ao movimento.
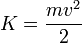 K-energia cinética
K-energia cinéticam- massa
v- velocidade
- A energia potencial gravítica- energia armazenada nos corpos que pode ser libertada.
m- masssa
g- gravidade
h- altura
Segundo a lei da conservação da energia, a energia total, que corresponde á soma da energia cinétia e da energia potencial gravítica é constante. Quando uma delas é máxima a outra é mínima.
Transferência e transformação de energia:
A energia é transferida da fonte de energia para o recetor.A energia elétrica transforma-se em:
- Energia sonora
- Energia luminosa
- Energia térmica
Maior parte das pessoas pensa que calor é quando a temperatura está elevada.
Mas essas pessoas estão ERRADAS, cientificamente!!!!!!!
Calor é a energia que se transfere entre dois corpos a temperaturas diferentes, até se alcançar um equilíbrio térmico.
Deixo- vos agora uma pequena curiosidade e uma ficha para consolidarem a matéria!!!
Curiosidade:
- A empresa de energia Genesis Energy lançou o jogo online ElectroCity. Cada jogador constrói uma cidade, onde as pessoas vão precisar de energia e empregos, mas não podem causar grandes impactos no meio ambiente.
Fontes e formas de energia- ficha de trabalho
Fontes e formas de energia- soluções
Subscrever:
Comentários (Atom)